APARATO GENITAL MASCULINO.
PENE
Malformaciones congénitas.
- Hipospadias
y epispadias. La malformación del surco uretral y el canal uretral puede
determinar aperturas anómalas tanto en la superficie ventral del pene
(hipospadias) como en la dorsal (epispadias).
- Fimosis.
El orificio del prepucio es demasiado pequeño para permitir su retracción
normal.
Inflamación. Afectan casi invariablemente al glande y al
prepucio y comprenden una amplia variedad de infecciones tanto específicas como
inespecíficas. La balanoprostatitis hace referencia a la infección del glande y
el prepucio causada por una amplia variedad de microorganismos.
Tumores.
- Benignos. Condiloma acuminado. Es un tumor
benigno de transmisión sexual causado por el virus del papiloma humano. Está
relacionado con la verruga común y puede presentarse en cualquier superficie
mucocutánea húmeda de los genitales externos de ambos sexos.
- Malignos. Carcinoma in situ. Dos tipos: enfermedad de Bowen que se presenta en
la región genital de hombres y mujeres, normalmente mayores de 35 años. En los
varones tiende a afectar a la piel del cuerpo del pene y el escroto. Aparece
como una placa solitaria, engrosada, blanca grisácea y opaca. La epidermis muestra
proliferación con numerosas mitosis, algunas atípicas. Las células son muy
displásicas con núcleos grandes e hipercromáticos y ausencia de maduración
ordenada. El borde dermoepidérmico está bien delimitado por una membrana basal
intacta. Papulosis bowenoide se
presenta en adultos sexualmente activos. Clínicamente, difiere de la enfermedad
de Bowen por la edad más temprana de los casos y por la presencia de lesiones
papulares de color marrón rojizo y múltiples (no solitarias), además nunca
evoluciona a carcinoma invasivo.
Carninoma
invasivo. Es un proceso maligno infrecuente. En el 50% de los casos
de carcinoma epidermoide de pene se detecta ADN del HPV (el tipo 16 es el
responsable más frecuente). La circuncisión confiere protección.
TESTÍCULOS Y EPIDÍDIMO.
Malformaciones congénitas. Criptorquidia. Representa un fracaso
completo o incompleto del descenso de los testículos intraabdominales hacia el
saco escrotal. Tiene lugar en dos fases. Durante la primera, la transabdominal,
los testículos llegan a apoyarse en la parte inferior del abdomen o en el borde
de la pelvis. Esta fase parece estar controlada por una hormona denominada
sustancia inhibidora mülleriana. En la segunda fase, inguinoescrotal, los
testículos descienden a través del canal hacia el saco escrotal. Esta fase
depende de los andrógenos y parece estar mediada por la liberación inducida por
los andrógenos de un péptido relacionado con el gen de la citonina, desde el
nervio genitofemoral. Aunque el descenso testicular está controlado por
factores hormonales, la criptorquidia sólo en raras ocasiones se asocia a un
trastorno hormonal bien definido.
Se
caracteriza por la detención del desarrollo de las células germinales asociado
a una importante hialinización y engrosamiento de la membrana basal de los
conductos espermáticos, que, finalmente, aparecerán como cordones densos de
tejido conjuntivo hialino rodeados por unas membranas basales prominentes. Se
aprecia el incremento simultáneo del estroma intersticial. Como las células de
Leydig están conservadas, aparecen prominentes. Por último se aprecia el
deterioro histológico, asociado a la escasez de células germinales, en los
testículos contralaterales de varones con criptorquidia unilateral, lo que
apoyaría la existencia de un defecto intrínseco del desarrollo testicular.
Además
de la esterilidad, la critorquidia se asocia a otras morbilidades. Cuando los
testículos se encuentran en el conducto inguinal, están particularmente
expuestos a los traumatismos y aplastamiento contra los ligamentos y los
huesos. La hernia inguinal acompaña a los testículos no descendidos en el
10-20% de los casos. Durante el primer año de vida, la mayoría de los
testículos inguinales criptorquídicos descienden espontáneamente hacia el
escroto. Los que se mantienen sin descender requieren la corrección quirúrgica,
preferiblemente antes del deterioro histológico, que sucede en torno a los 2
años de edad. La orquidopexia no garantiza la fertilidad.
Problemas vasculares. Torsión. La torsión del cordón
espermático estrangula el drenaje venoso de los testículos. Las arterias, de
paredes gruesas, se mantienen permeables, por lo que se produce una intensa
ingurgitación vascular que puede venir seguida por un infarto hemorrágico. La
torsión es una de las escasas urgencias urológicas. Las posibilidades de que
los testículos sean viables son buenas si se procede a la exploración
quirúrgica y se elimina manualmente la torsión en las primeras 6 hs de
evolución. Dependiendo de la duración del proceso, los cambios morfológicos
varían desde la congestión intensa a la extravasación general de sangre en el
tejido intersticial y el infarto testicular hemorrágico. En esos estadíos
avanzados, el testículo está muy aumentado de tamaño y se convierte
prácticamente en un saco de tejido blando, necrótico y hemorrágico.
Tumores del cordón espermático. Los
lipomas son lesiones frecuentes que afectan al cordón espermático proximal.
Aunque se diagnostican como lipomas muchas de estas lesiones representan una
masa de tejido adiposo retroperitoneal que ha sido arrastrada hacia el canal
inguinal junto al saco herniario y no constituyen una verdadera neoplasia. El
tumor paratesticular benigno más frecuente es el tumor adenomatoide; son
pequeños nódulos que aparecen cerca del polo superior del epidídimo. Pueden
tener un carácter mínimamente invasivo hacia los testículos adyacentes. Los
tumores paratesticulares malignos más frecuentes localizados en el extremo
distal del cordón espermático son los rabdomiosarcomas en niños y los liposarcomas
en adultos.
Tumores testiculares.
Seminoma. Son
los tumores de células germinales más frecuentes y suponen hasta el 50% de
todos los casos. Producen masas voluminosas, a veces con un tamaño diez veces
mayor que el del testículo normal. El seminoma típico tiene una superficie de
corte homogénea, blanca grisácea y lobulada sin hemorragias ni necrosis. El
seminoma típico está formado por sábanas de células uniformes divididas en
lóbulos mal definidos por delicados tabiques de tejido fibroso que contienen
una cantidad moderada de linfocitos. La célula clásica del seminoma es grande y
redonda o poliédrica y tienen una membrana celular diferenciada, un citoplasma
transparente o de aspecto acuoso y un gran núcleo central con uno o dos
nucléolos prominentes. El 15% de los seminomas contienen células
sinsitiotrofoblásticas. En un subgrupo de pacientes, las concentraciones
séricas de gonadotropina coriónica humana están elevadas.
Seminoma espermatocítico. Es
un tumor infrecuente que representa el 1-2% de todas las neoplasias testiculares
de células germinales. Los sujetos afectados suelen superar los 65 años. El seminoma
espermatocitico tiende a tener una superficie de corte blanda y gris clara, que
a veces contiene quistes mucoides. Contienen tres poblaciones celulares: 1)
células de mediano tamaño, las más numerosas con núcleos redondos y citoplasma
eosinófilo; 2) otras células más pequeñas con un ribete estrecho de citoplasma
eosinófilo que se parecen a los espermatocitos secundarios; 3) otras células
gigantes dispersas, que pueden ser uni o multinucleadas.
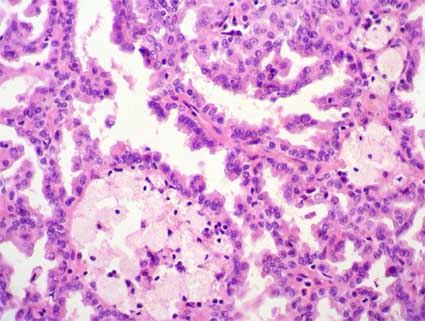
Carcinoma embrionario. Se presentan
principalmente en el grupo de 20-30 años de edad. El tumor es menor que el
seminoma y normalmente reemplaza a todo el testículo. Las células crecen
adoptando patrones alveolares o tubulares, a veces con circunvoluciones
papilares. Las lesiones más indiferenciadas pueden mostrar sábanas de células. Las
células neoplásicas tienen aspecto epitelial, son grandes y anaplásicas y presentan
núcleos hipercromáticos y nucléolos prominentes.

Tumor del saco vitelino. (tumor
del seno endodérmico). Es el tumor testicular más frecuente en lactantes y
niños de hasta 3 años de edad. El tumor no está encapsulado y en el corte se
presenta con un aspecto mucinoso homogéneo, amarillo o blanco. Es característica
una red a modo de encaje (reticular) de células cúbicas y aplanadas de mediano
tamaño. Además se pueden encontrar estructuras papilares, cordones sólidos de
células y muchos otros patrones infrecuentes. Dentro y fuera del citoplasma se
ven glóbulos eosinófilos parecidos a hialina, en los cuales se puede demostrar
la presencia de alpha-fetoproteina y alpha-1-antitripsina mediante tinciones
inmunohistoquímicas.
Coriocarcinoma. Es
una forma muy maligna de tumor testicular. Suponen menos del 1% de todos los
tumores de células germinales. A menudo no provocan un aumento del tamaño testicular y se detectan sólo como
un pequeño nódulo palpable. Las hemorragias y la necrosis son muy frecuentes. Los
tumores contienen dos tipos de células. Las sincitiotrofoblásticas son grandes
y tienen muchos núcleos hipercromáticos irregulares o lubulados y un abundante
citoplasma eosinófilo vacuolado. Las citotrofoblásticas son más regulares y
tienden a ser poligonales, con bordes diferenciados y citoplasma transparente.
Teratoma. Es
un grupo de tumores testiculares complejos que tienen varios componentes
celulares u organoides. Se presenta a cualquier edad. Son normalmente grandes,
con un tamaño que varía entre 5 y 10 cm de diámetro. Como están formados por
varios tejidos, el aspecto macroscópico es heterogéneo con zonas sólidas y a
veces cartilaginosas y quísticas. Los teratomas están formados por una
colección heterogénea desordenada de células diferenciadas o estructuras
organoides, como el tejido neural, haces musculares, islotes de cartílago,
grupos de epitelio escamoso, estructuras similares de la glándula tiroides,
epitelio bronquial o bronquiolar y fragmentos de pared intestinal o sustancia cerebral,
todo ella inmerso en un estroma fibroso o mixoide.


Tumores mixtos. El 60%
de los tumores testiculares está compuesto por más de uno de los puros. Las mezclas
más habituales son teratoma, carcinoma embrionario y tumor del saco vitelino,
seminoma con carcinoma embrionario y carcinoma embrionario con teratoma.
Tumores de los cordones sexuales y del
estroma gonadal.
Tumores de las células de Leydig. Pueden
elaborar andrógenos y en algunos casos, tanto andrógenos como estrógenos e
incluso corticoesteroides. Pueden aparecer a cualquier edad, sobre todo entre
los 20 y los 60 años. Forman nódulos circunscriptos, normalmente menores de 5
cm de diámetro. Tienen una superficie de corte homogénea y de color marrón dorado,
claramente diferenciada. Las células de Leydig neoplásicas son notablemente
similares a sus homólogas normales. El citoplasma contiene gránulos lipídicos,
vacuolas o pigmento lipofuscina, y en el 25% de los tumores se aprecian
cristaloides de Reinke alargados, que son más característicos.
Tumores de las células de Sertoli. aparecen
como pequeños nódulos firmes con una superficie de corte homogénea, blanca
grisácea o amarilla. Las células tumorales se organizan en trabéculas. La mayoría
son benignos, pero algunos (10%) siguen una evolución maligna.
----------------------------------------------------------------------------------------------------------------------------------

909. Corte histológico de un
coriocarcinoma con los dos componentes tumorales malignos trofoblásticos juntos, uno al lado del otro; hacia el lumen el sincitiotrofoblasto atípico y junto a él el citotrofoblasto maligno. HE x 500

910.
Coriocarcinoma marcado con gonadotrofina coriónica humana subunidad beta que señala de color café el sincitiotrofoblasto atípico responsable de la secreción de gonadotrofina. HCG x 500

911.
Teratoma con carcinoma embrionario y con seminoma, de aspecto abigarrado con áreas hemorrágicas, necróticas, blanquecinas, rosadas quísticas correspondientes a los diversos componentes del tumor.

912. Tejido testicular con tumor maligno intratubular (dentro de los túbulos seminíferos) correspondiente a un "
carcinoma in situ". HE x 200

913. La
neoplasia maligna intratubular del testículo derivada de células germinales la que puede marcarse con anticuerpo para fosfatasa alcalina placentaria con lo que se tiñe la membrana celular de color café. FacPl x 500

914.
Tumor adenomatoide del epidídimo, blanquecino, homogéneo, bien delimitado. El testículo se observa indemne.

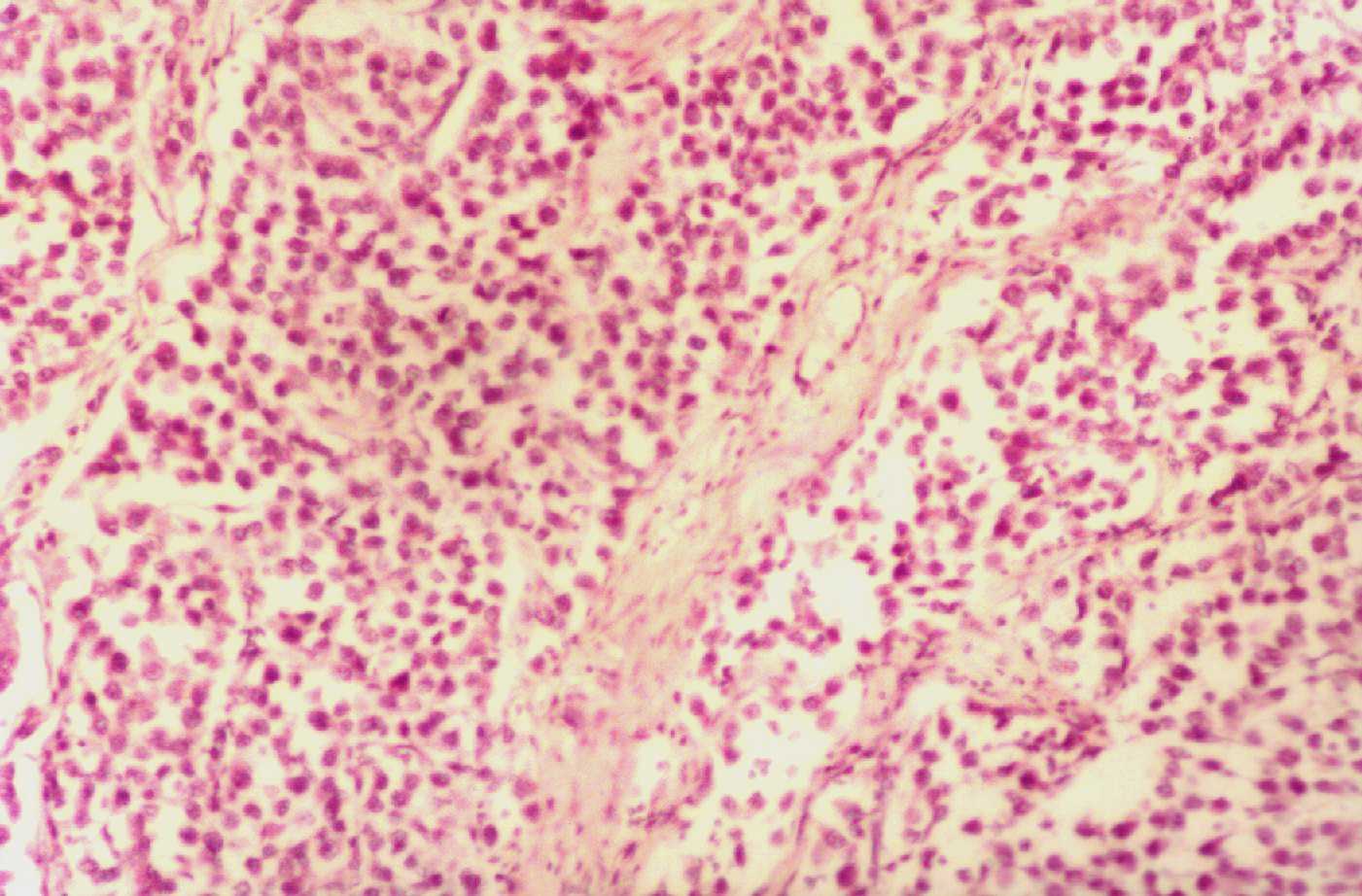
915.
Orquitis urleana con infiltrado intersticial predominantemente redondocelular entre los túbulos seminíferos. PAS x 200

916.
Epididimitis tuberculosa con epidídimo de aspecto caseoso y compromiso secundario testicular.

917.
Hidrocele con gran dilatación de la cavidad vaginal.
PRÓSTATA.
Inflamación. La
prostatitis se puede dividir en varias categorías: prostatitis bacterianas
agudas y crónicas, prostatitis abacteriana crónica y prostatitis granulomatosa.
Hiperplasia prostática benigna (HPB) o
hiperplasia nodular. Es muy frecuente en hombres mayores de 50
años. Se caracteriza por la hiperplasia del estroma prostático y de las células
epiteliales, con lo que se forman nódulos grandes. Pueden comprimir y estenosar
el canal uretral. Se pueden encontrar signos histológicos del HPB en el 20% de
los varones de 40 años de edad, en el 70% de los de 60, y hasta el 90% de los
de 80 años. Solo el 50% de los pacientes con signos microscópicos de HPB
presentan un aumento de tamaño clínicamente detectable de la próstata y, de
ellos, sólo el 50% desarrolla síntomas clínicos. Se ha propuesto que la causa
en un reducción global de la tasa de muerte celular con la acumulación
consecuente de células senescentes de la próstata. De acuerdo con esta teoría,
los andrógenos no sólo aumentan la proliferación celular, sino también inhiben
a la muerte celular. El principal andrógeno, la dihidrotestoterona. Por lo
tanto, las células del estroma son responsables del crecimiento prostático
dependiente de andrógenos.
MORFOLOGÍA.
Se caracteriza por un aumento de tamaño de la próstata. Se origina casi
exclusivamente en la cara interna de la próstata (zona de transición). Los nódulos
tempranos están formados casi en su totalidad por células estromales y más
tarde surgen los nódulos predominantemente epiteliales. Por su origen en esta
localización estratégica, los nódulos aumentados de tamaño pueden englobar las
paredes de la uretra, comprimiéndolas hasta formar un orificio de cerradura. Al
corte, cuando contienen principalmente glándulas, el tejido es amarillo o rosa,
de consistencia blanda y de ellas rezuma un contenido lechoso. Los nódulos
formados principalmente por estroma fibromuscular son de color gris claros,
duros y no rezuman líquido, estando menos delimitados del tejido prostático no
afectado circundante. La proliferación glandular adopta la forma de agregados
de glándulas pequeñas o grandes o con dilataciones quísticas, recubiertas por
dos capas, una capa cilíndrica interna y un epitelio cúbico o aplanado
exterior.
NO
se considera una lesión premaligna.
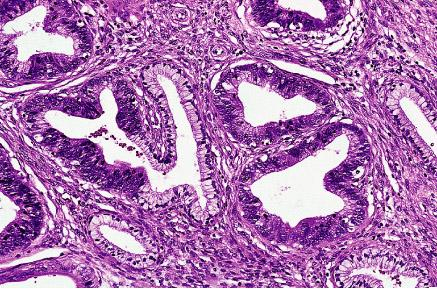
Adenocarcinoma. Es una
enfermedad típica de varones mayores de 50 años de edad; donde los andrógenos
tienen un importante papel en el desarrollo. Al igual que en sus homólogas
normales, el crecimiento y supervivencia de las células cancerosas prostáticas
depende de los andrógenos, que se unen a los receptores e inducen la expresión
de genes inductores del crecimiento y la supervivencia.
MORFOLOGÍA.
En el 70% de los casos surgen en la zona periférica de la glándula,
clásicamente en una localización posterior, donde se puede palpar en el tacto
rectal. El tejido neoplásico es arenoso y firme, pero puede ser difícil de ver
cuando está inmerso dentro del líquido prostático y es más evidente a la
palpación. Las glándulas son normalmente más pequeñas que las benignas y están
recubiertas por una sola capa uniforme de epitelio cúbico o cilíndrico bajo. Las
glándulas del cáncer de próstata están más apiladas y carecen de las
ramificaciones y los repliegues papilares interiores. La capa externa de
células basales, típico de las glándulas benignas, está ausente. El citoplasma
de las células tumorales varía, de un color pálido claro que se ve en las
glándulas benignas, a otro aspecto anfófilo característico. Los núcleos son
grandes y a menudo contienen uno o más nucléolos prominentes. Es difícil de
diagnosticar porque las claves de su malignidad suelen ser sutiles. En general el
diagnóstico se establece a partir de una constelación de datos morfológicos,
citológicos, y secundarios.